STRUCTURE ET FONCTIONS DES IMMUNOGLOBULINES
Les anticorps sont produits par les cellules B. Leur production est la contribution majeure des cellules B à la réponse immunitaire adaptative. Les anticorps ont été les premières molécules de la réponse immune spécifique à être caractérisées et sont encore aujourd’hui les mieux connues. Les anticorps forment dans leur ensemble une famille de protéines plasmatiques connues sous le nom d’immunoglobulines.
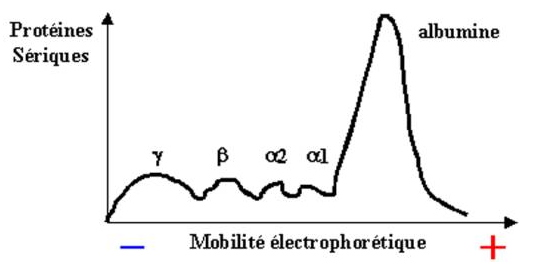
Figure 1 : Migration électrophorétique des immunoglobulines
La molécule d’immunoglobuline a deux fonctions distinctes : la première est de se fixer spécifiquement sur des molécules du pathogène qui a induit la réponse immunitaire ; la seconde est de recruter des cellules ou des molécules capables de détruire le pathogène contre lequel elle est dirigée. Ces fonctions sont structurellement séparées sur la molécule d’immunoglobuline. La partie responsable de la fixation sur l’antigène, dont la structure est extrêmement variable d’une molécule d’immunoglobuline à l’autre, est appelée région variable. Cette variabilité permet à chaque immunoglobuline de reconnaître un antigène particulier. L’ensemble du répertoire d’anticorps d’un individu est assez divers pour permettre la reconnaissance de n’importe quel antigène. La région de la molécule responsable des fonctions effectrices ne varie pas de façon aussi considérable. Cette région est appelée région constante bien qu’en fait elle puisse exister sous cinq formes différentes. Ces cinq formes caractérisent l’isotype de la molécule d’immunoglobuline. Ce sont les isotypes qui sont spécialisés dans l’activation de tel ou tel mécanisme effecteur.
La remarquable diversité des molécules d’anticorps est la conséquence des recombinaisons génétiques des gènes codant les immunoglobulines. Une cellule B ne produit pas d’anticorps tant qu’elle n’a pas été stimulée par un antigène spécifique. L’antigène est reconnu par les immunoglobulines de surface du lymphocyte B. La fixation d’un antigène sur ces récepteurs de surface est une étape indispensable à l’activation des cellules B et à leur différenciation en cellules productrices d’anticorps.
I - Structure générale d'une molécule d'immunoglobuline
A - Rappel historique
Le premier modèle de structure de la molécule d’immunoglobuline a été celui de Pauling en 1940. Il présentait une molécule d’immunoglobuline composée de deux sites de reconnaissance reliés par un pont rigide. Dans les années 60, Porter et Nisonoff montrèrent que le traitement d’une molécule d’immunoglobuline G par des enzymes générait des fragments aux propriétés fonctionnelles distinctes. Ils définirent ainsi les fragments Fab et Fc de la molécule d’immunoglobuline. Enfin, des expériences de réduction et de dissociation en milieu acide montrèrent que la molécule d’immunoglobuline était constituée de chaînes lourdes et légères reliées par des ponts disulfure. L’ensemble de ces données permit à Fleischman de proposer en 1964 le premier modèle d’une molécule d’immunoglobuline : deux chaînes lourdes identiques, liées chacune à une chaîne légère identique par des ponts disulfure.
L’étude des myélomes et des plasmocytomes a beaucoup contribué à la compréhension de la structure de la molécule d’immunoglobuline. On savait depuis longtemps que les anticorps constituaient un pool hétérogène de protéines sériques. Des tests biochimiques montrèrent au contraire que les patients atteints de myélome produisaient de fortes quantités d’une molécule d’immunoglobuline unique aisément purifiable du sérum. La possibilité d’obtenir de grandes quantités d’immunoglobulines purifiées permit d’une part d’obtenir des antisérums et ainsi de classer les immunoglobulines en groupes isotypiques, allotypiques et idiotypiques et d’autre part de réaliser des études cristallographiques qui permirent d’obtenir une représentation tridimensionnelle de la molécule d’immunoglobuline. Finalement, l’ensemble de ces données servirent de base au modèle structurel actuel de la molécule d’immunoglobuline.
B – Structure générale des molécules d’Ig
La molécule d’immunoglobuline a une forme en Y. Elle est constituée de trois segments de taille égale reliés par une zone de jonction flexible. Toutes les immunoglobulines ont une structure de base identique. Elles sont formées de deux paires de chaînes lourdes et légères reliées par des ponts disulfures. A l’intérieur de cette famille, on distingue cinq classes d’immunoglobulines : IgM, IgD, IgG, IgA et IgE qui peuvent être distinguées biochimiquement et fonctionnellement.
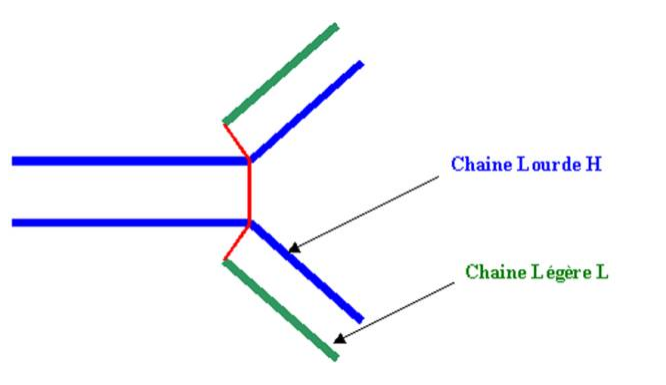
Figure 2 : Structure générale des molécules d’immunoglobulines.
B – 1 Structure de base d'une IgG1
La structure générale de tous les anticorps est suffisamment stéréotypée pour que l’on puisse considérer la molécule d’immunoglobuline G comme l’exemple type de la structure de base d’un anticorps.
Les immunoglobulines G sont des molécules multicatenaires symétriques. Leur masse moléculaire est d’environ 150 KD. Elles sont formées de quatre chaînes polypeptidiques homologues 2 à 2. La première, d’environ 50 KD, est appelée chaîne lourde (H). La seconde, de 25 KD, chaîne légère (L). Dans une molécule d’immunoglobuline G, les deux types de chaînes sont représentés dans un rapport équimolaire, ce qui implique que la molécule d’immunoglobuline est constituée de deux chaînes lourdes et de deux chaînes légères.
B – 1 – 1 Chaînes lourdes
Il existe cinq types de chaînes lourdes, désignées par les lettres grecques g,a,m,d,e qui définissent les cinq classes d’immunoglobulines, respectivement IgG, IgA, IgM, IgD, et IgE. Certaines classes d’immunoglobulines étant elles-mêmes divisées en sous classes comme pour les IgG et les IgA. C’est la région C terminale de chaque chaîne lourde qui conditionne l’activité fonctionnelle de l’anticorps.
B – 1 – 2 Chaînes légères
Il existe deux types de chaînes légères, appelées k et l (kappa et lambda). Chaque type de chaîne légère peut se combiner avec n’importe quel type de chaîne lourde. En revanche, tout comme pour les chaînes lourdes, une molécule d’immunoglobuline a deux chaînes légères identiques. Le rapport entre les anticorps porteurs de chaînes légères k et ceux porteurs de chaînes l varie d’une espèce à l’autre. Le rapport k/l est de 2/1 chez l’homme. Des modifications de ce rapport peuvent faire suspecter la présence de cellules B tumorales. Ce ne sont pas les chaînes légères qui déterminent les propriétés fonctionnelles de l’anticorps.
B – 2 La molécule d'immunoglobuline est organisée en domaines
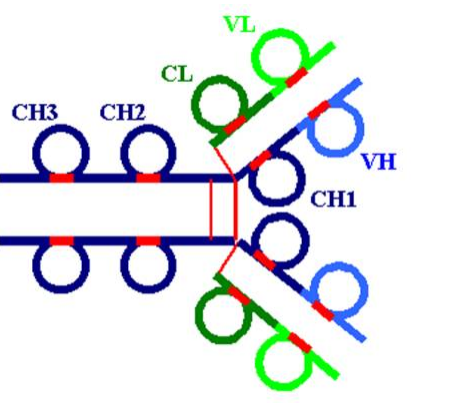
L’analyse de la structure des chaînes lourdes et légères révèle deux caractéristiques fondamentales de la molécule d’immunoglobuline. Premièrement, chaque chaîne est constituée de séquences similaires, sans être strictement identiques, d’environ 110 AA. Ces régions globulaires sont stabilisées par des ponts disulfure intracaténaires et sont appelées “domaines”. Les chaînes légères comprennent deux domaines alors que les chaînes lourdes des immunoglobulines G en possèdent quatre. La deuxième caractéristique est que chaque domaine aminoterminal des chaînes lourdes et légères varie considérablement d’un anticorps à l’autre. Les autres domaines des chaînes lourdes et légères sont constants. Ainsi, les deux domaines de la chaîne légère sont appelés VL et CL et les quatre de la chaîne lourde VH, CH1, CH2, CH3. La molécule d’immunoglobuline a une forme en Y. Chaque bras du Y est constitué de l’association d’une chaîne légère associée à la moitié aminoterminale de la chaîne lourde. L’association est telle que les domaines VH et VL sont appariés de même que les domaines CH1 et CL. L’association VVL constitue le site de fixation de l’anticorps pour l’antigène. Le reste de la molécule étant constitué de l’association des deux régions carboxy terminales des chaînes lourdes, les deux domaines CH3 des chaînes lourdes interagissent l’un avec l’autre, alors que la composition en sucres des domaines CH2 empêche une telle interaction.
Figure 3 : Organisation en domaines des molécules d’immunoglobulines.
B – 3 Sensibilité enzymatique de la molécule d'immunoglobuline
Des enzymes protéolytiques spécifiques de certaines séquences peptidiques ont été utilisées pour disséquer la structure de la molécule d’immunoglobuline. Elles ont permis de déterminer quelle partie de la molécule était impliquée dans les différentes fonctions des anticorps.
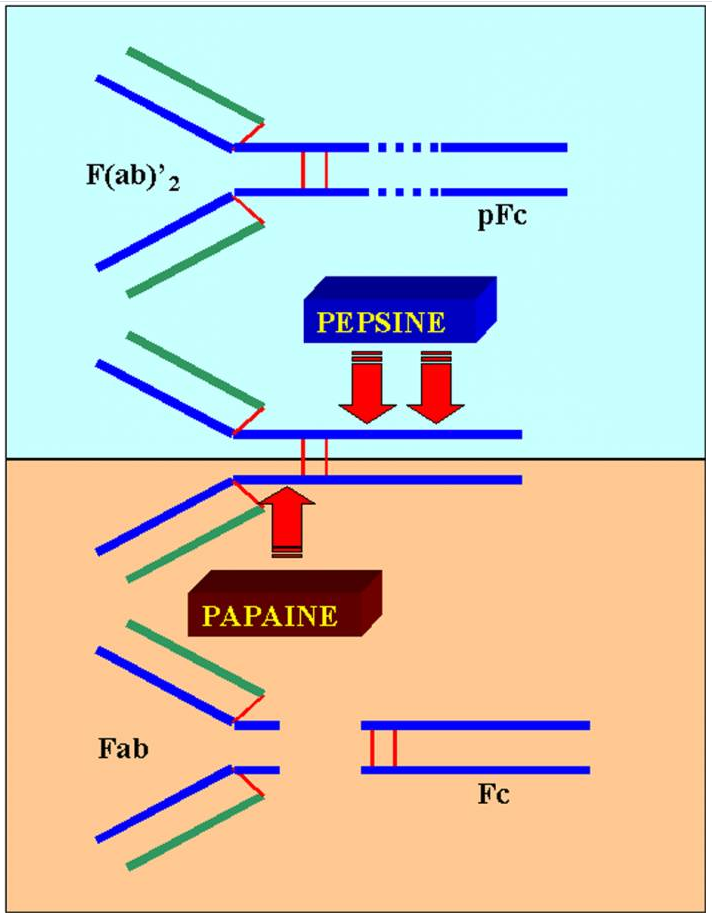
Des digestions partielles par la papaïne coupent la molécule en trois fragments. Deux d’entre eux sont identiques et sont capables de fixer l’antigène. Ils sont appelés fragments Fab pour ” fragment antigen binding “. Ils correspondent aux deux bras de la molécule d’immunoglobuline. Ils comprennent la chaîne légère complète associée aux domaines VH et CH1 de la chaîne lourde. Le dernier fragment ne fixe pas l’antigène mais a la propriété d’être aisément cristallisable à faible force ionique. Pour cette raison, il a été appelé fragment Fc (fragment cristallisable). Il correspond aux fragments CH2 et CH3 des deux chaînes lourdes. C’est cette partie de l’anticorps qui interagit avec les cellules et les molécules effectrices. Le profil exact des fragments obtenus après protéolyse dépend du site de coupure de la molécule d’immunoglobuline par rapport à la localisation des ponts disulfure. Ces ponts disulfure sont localisés dans la région charnière entre les domaines CH1 et CH2 des chaînes lourdes. La papaïne clive la molécule d’immunoglobuline dans la région amino-terminale des ponts disulfure. Une seconde enzyme, la pepsine, clive la molécule d’immunoglobuline dans la région C terminale des ponts disulfure. Cette enzyme produit un fragment F(ab)’2 composé des deux fragments Fab reliés par les ponts disulfure. Dans ce cas, la partie restante de la molécule est coupée en de nombreux petits fragments. Ainsi, si le F(ab)’2 a les mêmes caractéristiques que l’anticorps concernant la fixation de l’antigène, et il est incapable d’interagir avec aucune des cellules ou des molécules effectrices.
Figure 4 : Sensibilité enzymatique des molécules d’immunoglobulines.
B – 4 Flexibilité de la molécule d'immunoglobuline
La région charnière qui lie la région Fc aux Fab est extrêmement flexible. Cette propriété permet aux deux bras de l’anticorps d’avoir des mouvements indépendants. Une certaine flexibilité est aussi observée entre les régions V et C. Cette flexibilité permet la fixation des deux bras de l’anticorps sur des sites séparés par des distances variables.
B – 5 Domaines de la molécule d'immunoglobuline
Les domaines constants et variables des chaînes d’immunoglobulines ont des structures semblables mais pas strictement identiques. Les deux régions sont composées d’une chaîne polypeptidique organisée en deux couches antiparallèles avec de nombreux résidus hydrophobes entre les couches. L’une des couches comporte quatre segments, l’autre trois. Les deux sont reliées par un seul pont disulfure. La différence principale entre les domaines constants et variables réside dans la taille supérieure du domaine variable et la présence d’un repliement supplémentaire. Ce repliement du domaine V permet le rapprochement des zones hypervariables sous forme de trois boucles distinctes, mais très rapprochées. C’est cette région qui est impliquée dans la fixation de l’antigène.
B – 6 Variabilité des anticorps
B – 6 – 1 Variation isotypique
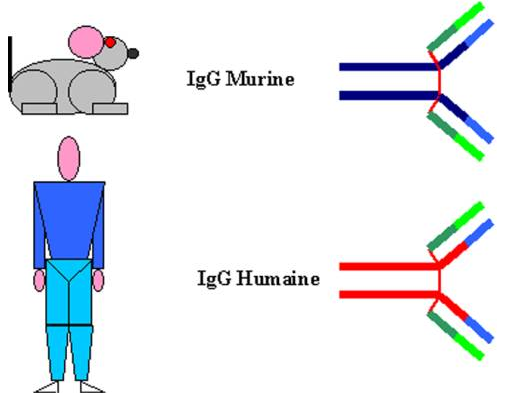
Lorsqu’une immunoglobuline humaine est injectée à l’animal elle est prise en charge comme n’importe quel autre antigène étranger et induit une réponse anticorps dirigée contre l’immunoglobuline injectée. Les anticorps anti-immunoglobuline sont dirigés contre des acides aminés qui caractérisent l’isotype de la molécule. Ces anticorps anti-isotype reconnaîtront toutes les immunoglobulines de même isotype provenant de l’espèce de l’immunoglobuline injectée. Par exemple, l’injection d’immunoglobulines A humaines à la souris va induire la production d’anticorps anti-immunoglobulines A humaines. Ces anticorps pourront reconnaître toutes les immunoglobulines A humaines quel que soit le sérum humain dont les immunoglobulines A proviennent. Par contre, ces anticorps ne pourront pas reconnaître les immunoglobulines A provenant d’une autre espèce que l’homme.
Figure 5 : Variation isotypique.
B – 6 – 2 Variation allotypique
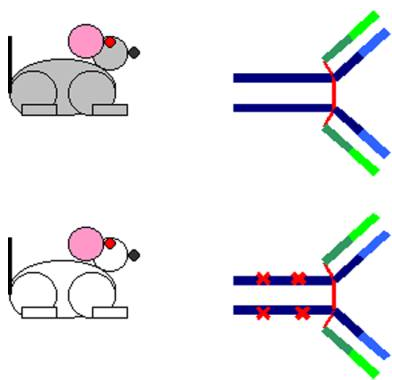
La variation allotypique rend compte de variations génétiques à l’intérieur d’une même espèce. Elle est due à la présence de plusieurs allèles à un même locus. Ces variants allèliques sont appelés allotypes. Un allotype donné n’est pas rencontré chez tous les individus d’une même espèce. Par exemple, le variant allotypique G3m (b˚) de l’immunoglobuline G3 est caractérisée par la présence d’une phénylalanine en position 436 de la chaîne lourde, qui n’est pas retrouvée chez tous les individus. Les allotypes sont le plus souvent des variants des régions constantes des chaînes lourdes.
Figure 6 : Variation allotypique.
B – 6 – 3 Variation idiotypique
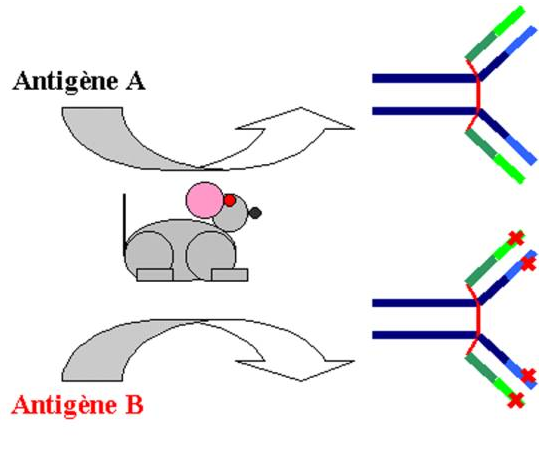
Les modifications de la séquence en acides aminés de la région variable, en particulier dans la zone hypervariable directement responsable de la spécificité du site anticorps, déterminent l’existence des idiotypes. Un idiotype est généralement spécifique d’un seul clone de lymphocyte B (idiotype privé). Il peut cependant arriver que des clones différents expriment le même idiotype (idiotype public, croisé ou récurrent).
Figure 7 : Variation idiotypique.
C – Structure des différentes classes et sous-classes d’Ig.e
On distingue chez la plupart des mammifères cinq classes d’immunoglobulines : IgM, IgG, IgA, IgD, et les IgE. Elle diffèrent par leur poids moléculaire, leur charge, leur composition en acides aminés et en sucres. A ces différences entre les classes s’ajoute une hétérogénéité à l’intérieur de chaque classe. Après électrophorèse, les Ig apparaissent hétérogènes et se répartissent entre les fraction g et a du sérum normal. Toutes les Immunoglobulines sont glycosylées. Leur composition en sucres varie de 2 à 3% pour les IgG à 12-14% pour les IgM, les IgD et les IgE.
C - 1 Les IgG
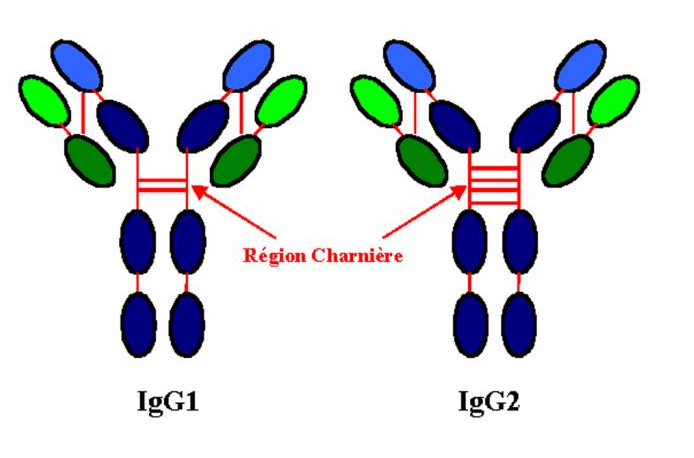
Les IgG sont les immunoglobulines majoritaires du sérum normal. Elle représentent 75% des Ig totales (de 8 à 18 g/l dans le sérum) et sont réparties en 4 sous-classes IgG. L’IgG est un monomère de 7S de poids moléculaire 146 kD. Les IgG3 ont un poids moléculaire légèrement plus élevé que les autres Ig car la chaîne g3 est un peu plus longue. Les IgG sont réparties uniformément dans les compartiments intra- et extravasculaires. Leur fonction essentielle est la neutralisation des toxines bactériennes. Elles constituent la classe majoritaire lors de la réponse secondaire.
Il n’y a pas deux sous-classes d’IgG humaine qui aient le même nombre ou la même distribution de pont disulfure. La liaison chaînes lourdes-légères est situé dans la zone de jonction ente la région variable et la région constante des chaînes lourdes pour les IgG2, IgG3, et IgG4. Le nombre de liaisons entre les chaînes lourdes est de deux pour les IgG1 et les IgG4, quatre pour les IgG2 et quinze pour les IgG3.
Figure 8 : Structure des molécules d’IgG.
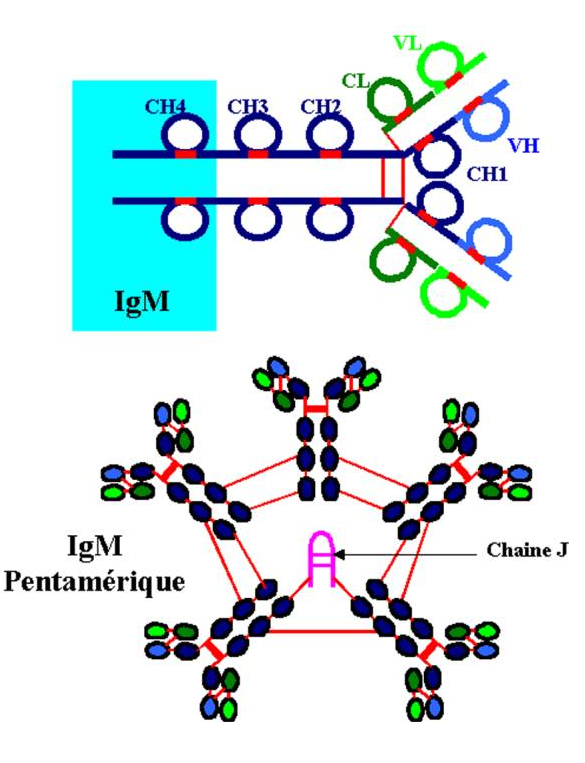
C - 2 Les IgM
Les IgM représentent environ 10% des Ig totales (1 à 2g/l dans le sérum). La molécule a une structure pentamèrique. Chaque chaîne lourde a un poids moléculaire d’environ 65 kD, l’ensemble atteignant 970 kD. Les IgM, essentiellement confinées au compartiment intravasculaire, constituent la plupart des Ac ” naturels ” produits par les ? et sont majoritaires lors de la réponse primaire anti-infectieuse.
Les IgM ont une structure pentamèrique. Les chaînes m diffèrent des chaînes g par leur séquence en acide aminés et possèdent un domaine constant supplémentaire. Les cinq sous-unités sont reliées par des ponts disulfures. La chaîne m est très riche en sucres. L’IgM possède un peptide supplémentaire : la chaîne J est un peptide de 137 acides aminés riche en cystéine incorporé dans la molécule d’IgM par des ponts disulfure. Elle assure la polymérisation en pentamère.
Figure 9 : Structure des molécules d’IgM.
C - 3 Les IgA
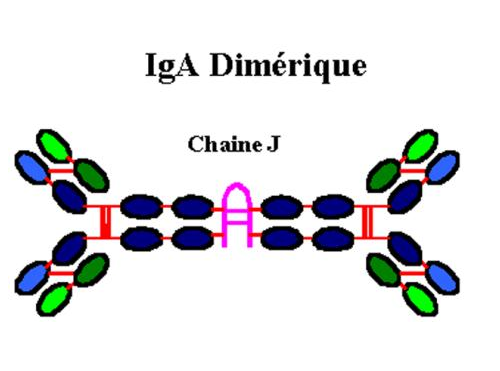
Les IgA représentent 15 à 20% des Ig sériques (3,5 à 4,5 g/l). Plus de 80% des IgA humaines sont sous forme monomèrique. Les IgA sont majoritaires dans les sécrétions muqueuses (salive, colostrum, lait, sécrétions bronchiques et uro-génitales).
Les IgA sécrétoires peuvent appartenir à l’une ou l’autre sous classe d’IgA (IgA1 et IgA2) et existent principalement sous forme dimérique de 385 kD. L’IgA sécrétoire est abondante dans les sécrétions muqueuses où elle est associée à une autre protéine : la pièce sécrétoire.
La chaîne lourde a des IgA possèdent un domaine variable et trois domaines constants. Les polymères d’IgA sériques et les IgA sécrétoires possèdent, comme les IgM, la chaîne J. Les domaines Ca1 et Ca2 possèdent un pont disulfure intracaténaire supplémentaire. Les IgA sécrétoires sont formées de deux unités d’IgA, d’une pièce sécrétoire et d’une chaîne J. La pièce sécrétoire n’est pas synthétisée par les plasmocytes mais par les cellules épithéliales. L’IgA maintenue sous forme de dimère par la chaîne J est sécrétée par les plasmocytes sous-épithéliaux. Elle se lie à la pièce sécrétoire au cours de la traversée de la barrière epithéliale. La pièce sécrétoire facilite le transport des IgA dans les sécrétions et les protège de la protéolyse . La sous-classe IgA1 est majoritaire dans le sérum La sous-classe IgA2 est majoritaire dans les sécrétions.
Figure 10 : Structure des molécules d’IgA.
C - 4 Les IgD
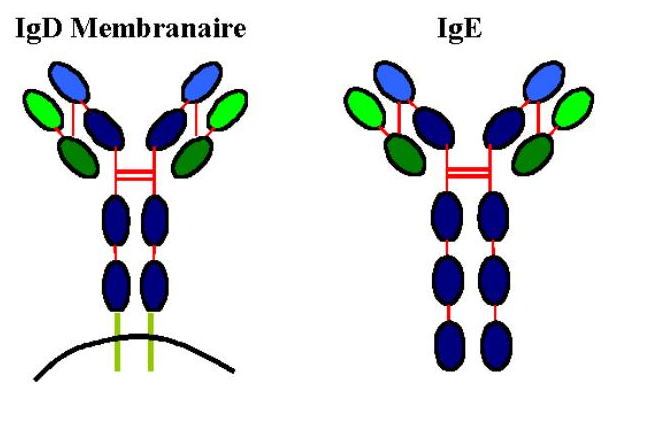
Les IgD représentent moins de 1% des Ig plasmatiques. Elle est présente en grande quantité à la surface de la plupart des lymphocytes B circulants. La fonction biologique de l’IgD n’est pas connue précisément, mais son rôle dans l’induction de la différentiation du lymphocyte B par l’antigène semble désormais bien établi.
L’IgD n’a qu’un seul pont disulfure entre les chaînes d. La chaîne d est très riche en sucres.
C - 5 Les IgE
Les IgE sont retrouvées sous forme de traces dans le sérum. Les IgE sont présentes à la surface des mastocytes et des basophiles, combinées à un récepteur de haute affinité pour cette classe d’Ig (Rfce1). Les IgE jouent un rôle dans l’immunité anti-parasitaire contre les helminthes,et dans les réactions d’hypersensibilité immédiate.
Le poids moléculaire plus élevé de la chaîne e s’explique par le plus grand nombre d’acides aminés (environ 550) répartis sur cinq domaines : un variable et quatre constants.
Figure 11 : Structure des molécules d’IgD et d’IgE.
II – Interaction antigène-anticorps.
A – Site de liaison antigène-anticorps
Certaines séquences d’acides aminés des régions variables des chaînes lourdes et légères ont une très grande variabilité et sont appelées régions hypervariables. Pour les chaînes légères k et l, ces régions sont localisées autour des positions 30, 50 et 95. Ces mêmes séquences déterminent directement le site de liaison à l’antigène. C’est la raison pour laquelle on les appellent aussi ” régions déterminant la complémentarité ” (CDR=complementary determining region). Les segments intermédiaires sont nettement moins variables et sont appelés régions charpentes (FR=framework). Chaque domaine VL et VH est ainsi composé de trois CDR (CDR1-CDR3) et de 4 FR (FR1-FR3). Le repliement des chaînes peptidiques des régions VL et VH permet de rapprocher dans l’espace les 6 CDR qui forment chacun une boucle, l’ensemble constituant le site de liaison de l’antigène.
De nombreuses liaisons non-covalentes participent à l’interaction entre l’antigène et les acides aminés du site anticorps. Bien que ces forces attractives (liaisons hydrogène, hydrophobes, forces de Van der Waals et électrostatiques) soient faibles, leur grand nombre permet une énergie de liaison élevée. Les liaisons hydrogène résultent de la formation de ponts hydrogène entre les atomes appropriés. Les forces électrostatiques sont dues à l’attraction de deux groupes ioniques de force opposées, situés sur les chaînes latérales des deux polypeptides. Les forces de Van der Waals sont créées par les interactions entre les différents nuages électroniques. Les liaisons hydrophobes sont produites par l’association de groupements non polaires et hydrophobes d’où les molécules d’eau sont exclues. La distance optimale entre les groupes réactifs varie avec le type de liaison. La distance qui sépare les différents groupes réactifs est un facteur critique pour l’établissement de liaisons non covalentes. Le déterminant antigénique (épitope) et le site anticorps (paratope) doivent donc posséder des structures complémentaires capables de se combiner. Ainsi, il doit exister des groupements atomiques appropriés sur la molécule d’antigène et d’anticorps et la forme du site anticorps doit être adaptée à l’antigène pour que plusieurs liaisons non covalentes puissent être formées simultanément. Des études cristallographiques ont montré comment les antigènes protéiques interagissaient avec les anticorps spécifiques. L’examen de l’interaction entre le lysozyme et la partie Fab d’un anticorps spécifique montre que l’épitope et le site de liaison ont des surfaces complémentaires et que celles-ci sont même plus étendues que les régions hypervariables. Toutes les régions hypervariables contribuent à la formation du site de liaison de l’anticorps, bien que la troisième région hypervariable de la chaîne lourde formée par le jonction VDJ semble être la plus importante. Ceci est dû à la variabilité beaucoup plus grande qui est générée par la combinaison des éléments génétiques V, D et J.
B – Affinité et avidité des anticorps
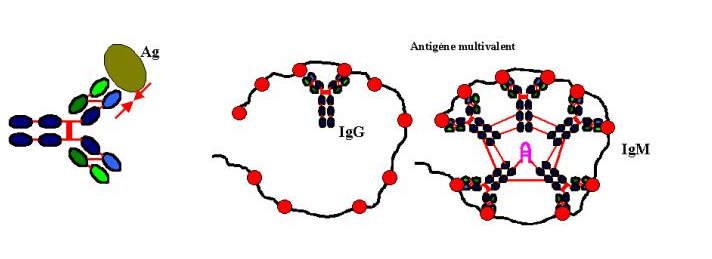
La force de liaison antigène-anticorps est appelée affinité de l’anticorps. Elle représente la résultante des forces attractives et répulsives entre l’antigène et l’anticorps. L’interaction entre le site anticorps et l’antigène peut être mesurée thermodynamiquement. Le calcul de l’affinité d’un site anticorps requiert l’utilisation de l’antigène monovalent. Les liaisons non-covalentes entre un anticorps et l’épitope reconnu sont dissociables. L’ensemble de la liaison entre un antigène et un anticorps est donc une réaction réversible. Dans ce cas, la loi d’action de masse peut être appliquée et la constante d’équilibre K déterminée : c’est la constante d’affinité. De nombreuses méthodes permettent de calculer l’affinité d’un anticorps. Dans tous les cas on doit choisir des conditions expérimentales où la réaction antigène/anticorps est à l’équilibre : Ag+Ac ¤ AgxAc. Les quantités d’antigènes libres et complexés sont alors mesurées. Les IgG, A, D, E sont divalentes car elles possèdent deux sites de liaison. Les IgM sont décavalentes. L’antigène lui-même peut être monovalent ou multivalent. Un haptène ne représente qu’un seul déterminant antigénique et ne peut donc réagir qu’avec un seul site anticorps : c’est une structure monovalente. La plupart des molécules possèdent plus d’un déterminant antigénique. Les microorganismes possèdent à leur surface de nombreux déterminants antigéniques et forment donc des antigènes multivalents. Quand un antigène multivalent se combine à plus d’un site anticorps, l’énergie de liaison qui en résulte est bien supérieure à la somme des énergies de liaison de chacun des sites impliqués. L’avidité désigne la force avec laquelle un anticorps multivalent se fixe à un antigène plurivalent. Elle dépend donc de l’affinité de chacun des sites anticorps pour les différents déterminants antigéniques. L’évaluation de l’affinité et de l’avidité des anticorps renseigne sur la nature de la liaison antigène-anticorps. Ces définitions ont un intérêt pratique, puisque l’affinité et l’avidité d’un anticorps conditionnent ses propriétés physiologiques et pathologiques.
Les anticorps de forte affinité sont plus efficaces que les anticorps de faible affinité dans un bon nombre de réactions biologiques. Ils sont en effet plus efficaces dans les réactions d’hémolyse, d’hémagglutination et de fixation du complément. Ils favorisent l’élimination immune de l’antigène et peuvent neutraliser virus, bactéries et enzymes.
En immunopathologie, des complexes Ag-Ac de faible affinité persistent longtemps dans la circulation peuvent se déposer sur la membrane basale des glomérules et provoquer des lésions rénales.
L’affinité des anticorps pour la plupart des antigènes thymo-dépendants augmente au cours de la réponse immunitaire. Cette propriété est utilisée pour le diagnostic d’infections virales, bactériennes ou parasitaires au cours de la grossesse. En effet, chez la femme enceinte, certaines infections comme la rubéole ou la toxoplasmose peuvent avoir des conséquences graves sur le développement foetal. Le suivi sérologique de ces infections est donc primordial. La difficulté majeure de ce suivi réside dans la possibilité de pouvoir faire la distinction entre une infection récente, donc menaçante pour le foetus, et une immunité ancienne. Si les immunoglobulines M spécifiques de l’agent infectieux signent une infection récente, leur présence est très fugace et dans de nombreux cas seules les immunoglobulines G sont détectées. Dans ce cas, une des possibilités pour réaliser le diagnostic différentiel entre infection récente et ancienne est de mesurer l’avidité des anticorps spécifiques. Lors d’infections anciennes, l’avidité des anticorps est forte alors qu’elle est faible lors d’infections récentes. La technique utilisée pour mesurer l’avidité des anticorps repose sur la mesure de la dissociation en phase solide de la liaison antigène-anticorps par des agents chaotropiques.
Figure 11 : Affinité/avidité.
C - Spécificité des anticorps
Les réactions antigènes-anticorps sont des réactions très spécifiques. Ainsi, les anticorps dirigés contre le virus de la rougeole, qui assurent une immunité spécifique contre cette maladie, se lient uniquement au virus de la rougeole mais pas à des virus non-apparentés comme celui de la poliomyélite. La spécificité d’un immun sérum résulte de l’addition de la réactivité de tous les anticorps présents, chacun d’eux réagissant avec différentes régions de la molécule d’antigène et même avec différentes parties du même déterminant. Cependant, lorsque certains déterminants d’un antigène A sont communs avec ceux d’un autre antigène B, on parle de réactions croisées. Ces réactions croisées sont à la base de certaines hypothèses physiopathologiques expliquant l’émergence de phénomènes auto-immuns. En effet, certains entérovirus comme le virus Coxsackie B4 possèdent des déterminants communs avec la GAD, un des auto-antigènes du diabète insulino-dépendant. Ainsi, certaines cellules immunocompétentes activées au cours de l’infection virale pourraient réagir avec des composants du soi et donc être à l’origine des manifestations auto-immunes observées au cours du diabète.
L’anticorps reconnaît plutôt la configuration de l’épitope (épitope conformationnel) que des groupements chimiques particuliers (épitope linéaire). Ils reconnaissent de petites différences dans la structure primaire d’un antigène, des différences de charges ou des différences de conformation stérique. Par conséquent, de nombreux anticorps vont se lier seulement à des antigènes natifs ou à des fragments d’antigène ayant conservé la structure tertiaire de l’antigène natif, permettant les interactions nécessaires à la formation des liaisons antigènes-anticorps. Cette spécificité conformationnelle soulève des difficultés quand on souhaite produire des anticorps utilisables comme réactifs ou dans des protocoles de vaccination. En effet, s’il est plus facile d’immuniser à l’aide de polypeptides synthétiques plutôt qu’avec l’antigène natif purifié, la réactivité des anticorps anti-peptides avec l’antigène natif n’est pas toujours obtenue.
Le fait que n’importe quelle région variable puisse être associée à n’importe quelle région constante au cours de la commutation de classe fait que les cellules B, spécifiques d’un même antigène, puissent produire des anticorps succeptibles d’activer les mécanismes effecteurs conduisant à l’élimination du pathogène dans n’importe quel compartiment de l’organisme.
Les premiers anticorps produits au cours de la réponse immune sont des IgM car la région Cm est la première région en 5’ des segments VDJ. Cette réponse précoce à base d’IgM a lieu avant les mutations somatiques et les anticorps produits sont généralement de faible affinité. Toutefois, les IgM sont des pentamères et possèdent donc 10 sites de fixation pour l’antigène. La faible affinité des IgM est donc compensée par la forte avidité de ces anticorps. La forme pentamérique des IgM leur confère une masse moléculaire élevée qui restreint leur champ d’action au compartiment sanguin. Toutefois, cette structure rend les IgM particulièrement aptes à activer les protéines du complément. La présence de microorganismes dans le sang peut avoir des conséquences désastreuses si l’infection n’est pas contrôlée rapidement. La production rapide d’IgM capables d’activer le complément permet une intervention immédiate du système immunitaire. Les anticorps d’isotypes IgA, IgG et IgE sont de plus petite taille et diffusent donc plus aisément du sang vers les tissus. Les IgA peuvent former des dimères, mais les IgG et les IgE sont retrouvées essentiellement sous forme monomérique. L’affinité de ces anticorps pour l’antigène est déterminante pour leur efficacité. Après la commutation isotypique, les cellules B de forte affinité sont sélectionnées dans les centres germinatifs. Les IgG sont majoritaires dans le sang et les liquides extracellulaires alors que les IgA sont principalement retrouvées dans les sécrétions muqueuses, notamment bronchiques et intestinales. Les IgA sont beaucoup moins capables d’opsoniser les microorganismes et activent moins bien le complément que les IgG. Ces différences s ‘expliquent par la prédominance des IgG dans les compartiments de l’organisme où les cellules phagocytaires et les protéines du complément sont largement disponibles. Au contraire, dans les sécrétions muqueuses, ces cellules et protéines effectrices ne sont pas naturellement présentes. Les IgA agissent donc à ce niveau comme des anticorps neutralisants. Les IgE sont présentes à faible concentration dans le sang et les liquides extracellulaires. Les IgE se lient fortement par leur fragment Fc sur des récepteurs présents sur les mastocytes. Ces cellules sont présentes dans la sous-muqueuse, dans le derme et le long des vaisseaux sanguins du tissu conjonctif. La fixation de l’antigène sur les IgE induit la libération d’histamine responsable des réactions d’hypersensibilité de type I.
III – Fonctions effectrices des anticorps
A – Fonctions portées par le fragment Fab
A –1 – Réactions de neutralisation des toxines bactériennes
De nombreuses bactéries exercent leur pouvoir pathogène en sécrétant des protéines appelées ” toxines “. Ces toxines peuvent endommager ou détruire les cellules de l’hôte. Pour exercer son pouvoir pathogène, la toxine doit interagir avec un récepteur spécifique à la surface de la cellule cible. De nombreuses toxines sont ainsi constituées de deux sous-unités : la première interagit avec le récepteur cellulaire spécifique et permet l’internalisation de la toxine, la deuxième est directement responsable de l’effet toxique. Les anticorps qui se fixent par l’intermédiaire de leur fragment Fab sur le site d’interaction entre la toxine et son récepteur empêchent la pénétration intracellulaire de la toxine et donc ses effets pathogènes. Cet effet protecteur est appelé ” neutralisation ” et les anticorps qui agissent ainsi sont appelés anticorps neutralisants.
Figure 12 : Anticorps neutralisants.
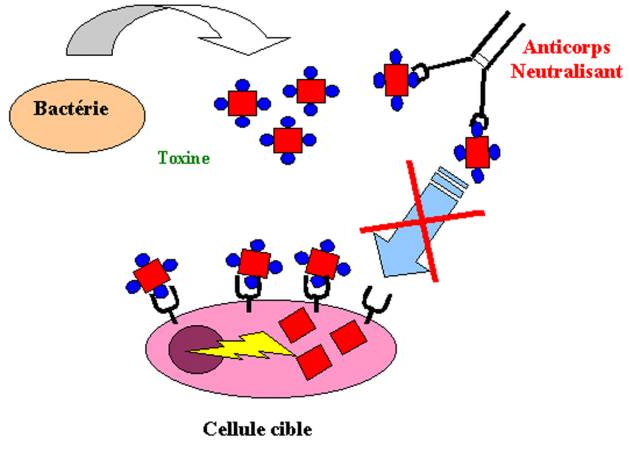
La plupart des toxines sont actives à des concentrations de l’ordre du nanomolaire. Ainsi, une seule molécule de toxine diphtérique peut tuer une cellule. Pour neutraliser efficacement la toxine, les anticorps doivent diffuser dans les tissus et se fixer rapidement et avec une forte affinité sur la toxine.
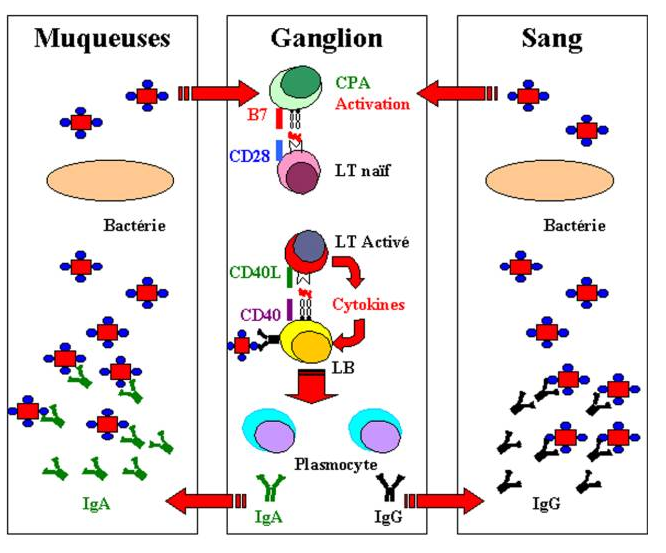
La large diffusion des IgG associée à leur forte affinité pour les antigènes fait de cette classe d’Ig la principale ligne de défense contre les toxines dans le compartiment extracellulaire. Les IgA neutralisent efficacement les toxines présentes au niveau des surfaces muqueuses de l’organisme.
Figure 13 : Diffusion des anticorps.
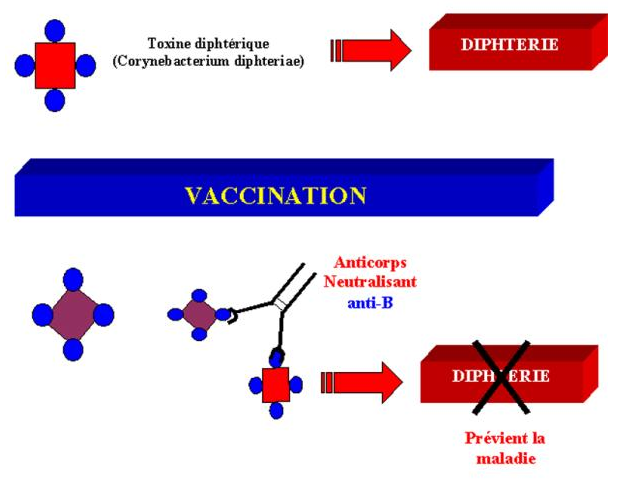
Les toxines diphtériques et tétaniques sont des protéines sur lesquelles l’activité toxique et la zone d’interaction cellulaire sont situées sur deux régions différentes. Il est donc possible d’immuniser des individus, généralement des enfants, avec des toxines dont la chaîne responsable de l’activité toxique a été dénaturée. Ces molécules de toxine ne possèdent plus d’activité toxique mais possèdent encore leur site de fixation. Ainsi, l’immunisation avec ces toxines induit des anticorps neutralisants capables d’empêcher la toxine native de se fixer sur la cellule cible.
Figure 14 : Vaccination.
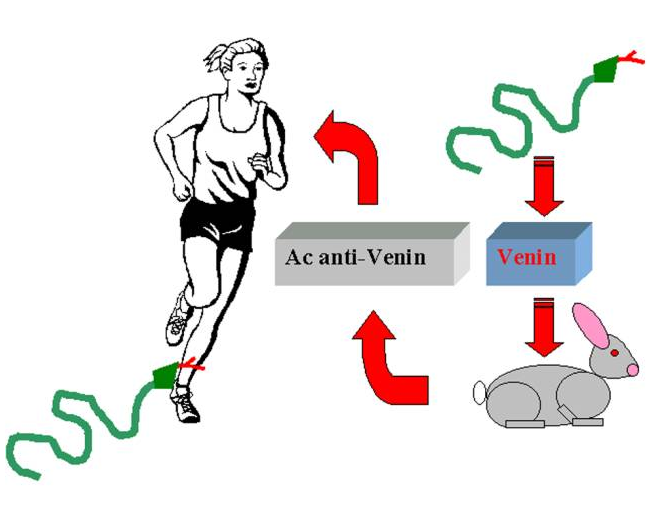
L’exposition à certains venins d’insecte ou de serpents est quelquefois si toxique qu’une seule exposition peut causer des dommages tissulaires majeurs et dans certains cas la mort de l’hôte. Dans ce cas, la réponse immunitaire adaptative est trop lente pour protéger l’individu. Comme l’exposition à de tels venins est rare, aucun des vaccin humain n’a été développé pour prévenir ce type d’agression toxique. Toutefois, l’immunisation d’animaux avec ces venins permet la production d’anticorps anti-venin susceptibles d’être utilisés pour empêcher la survenue de symptôme après piqûre. L’injection de ces anticorps à l’homme est appelée ” sérothérapie “. Il s’agit d’une immunisation passive, qui s’oppose à l’immunisation active par vaccination.
Add Your Heading Text Here
A – 2 – Blocage de l’infectiosité des virus
Lorsqu’un virus infecte une cellule, il doit d’abord se fixer sur un récepteur membranaire spécifique. Cette fixation détermine le tropisme du virus pour une cellule déterminée. Ainsi, le virus de la grippe possède à sa surface des protéines appelées hémagglutinines qui se fixent sur les acides sialiques terminaux présents sur certaines glycoprotéines des cellules de l’épithélium respiratoire. Les anticorps dirigés contre l’hémagglutinine préviennent l’infection grippale. Les IgG et les IgA de forte affinité sont particulièrement impliquées dans la neutralisation des virus.
Si la majorité des anticorps neutralisants bloquent la fixation du virus à la surface cellulaire, l’interaction entre le virus et l’anticorps peut désorganiser la structure de la particule virale prévenant ainsi la fusion de la membrane virale à la surface cellulaire.
Figure 16 : Blocage de l’infectiosité des virus.
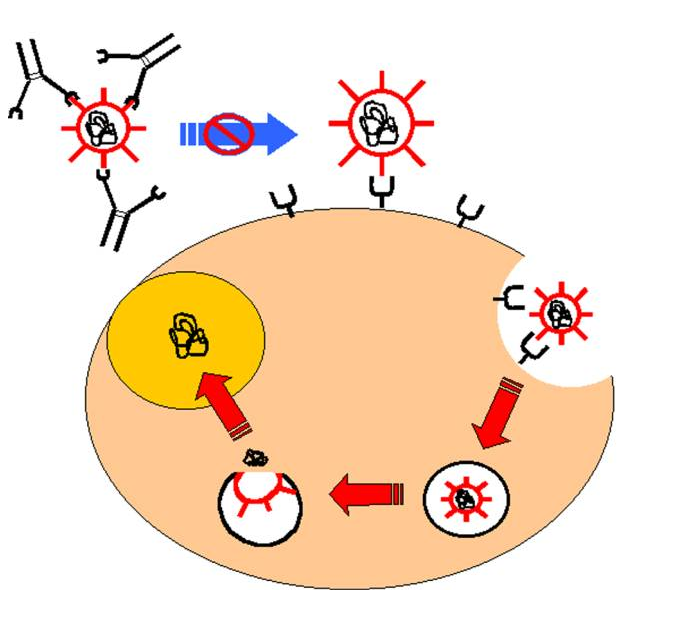
A – 3 – Inhibition de l’adhésion bactérienne aux surfaces cellulaires
De nombreuses bactéries possèdent des protéines d’adhérence appelées ” adhésines ” qui leur permettent de se fixer à la surface des cellules. Cette réaction d’adhérence est nécessaire à l’expression du pouvoir pathogène des bactéries intracellulaires ou non. Ainsi la ” piline ” de Neisseria gonorrhoeae permet l’adhérence de cette bactérie aux cellules épithéliales urinaires et génitales. Cette protéine est essentielle à la virulence du germe. Des anticorps dirigés contre cette protéine inhibent l’adhérence et préviennent l’infection.
Figure 17 : Inhibition de l’adhésion bactérienne.
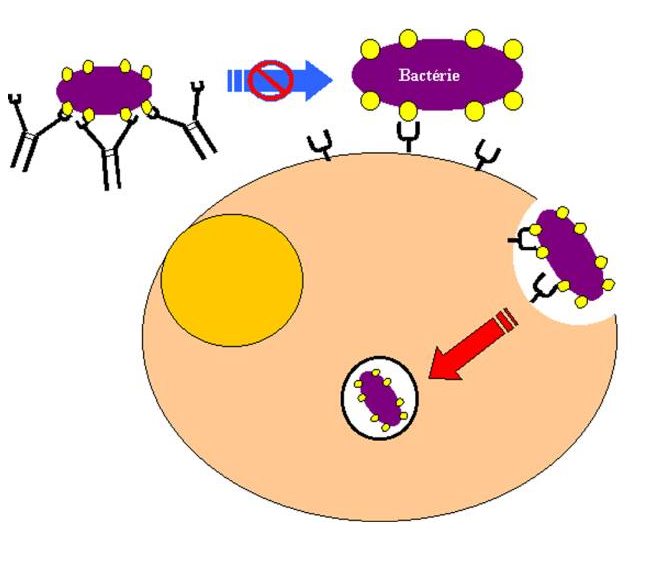
B – Fonctions portées par le fragment Fc
B – 1 – Introduction
Les bactéries extracellulaires se distribuent largement dans l’organisme. Les anticorps doivent donc pouvoir diffuser aisément pour les neutraliser. La plupart des anticorps diffusent de leur site de synthèse vers tous les compartiments de l’organisme. Toutefois, des mécanismes de transport spécialisés sont nécessaires pour délivrer des anticorps vers certains épithéliums comme ceux du poumon ou de l’intestin.
Figure 17 : Les anticorps participent à l’élimination active des micro-organisme par l’intermédiaire de leur fragment Fc.
La localisation des anticorps est déterminée par leur isotype qui peut limiter leur diffusion ou au contraire favoriser leur transport vers différents compartiments.
Les pathogènes pénètrent dans l’organisme en traversant les barrières épithéliales muqueuses respiratoires, digestives, uro-génitales ou en traversant la peau lésée. Moins fréquement, des insectes, une blessure ou des seringues hypodermiques introduisent les microbes directement dans la circulation sanguine. Finalement, les muqueuses, les tissus et le compartiment extracellulaire doivent tous être protégés de ces infections par des anticorps. Certains isotypes d’anticorps sont plus ou moins adaptés pour agir dans différents compartiments de l’organisme.
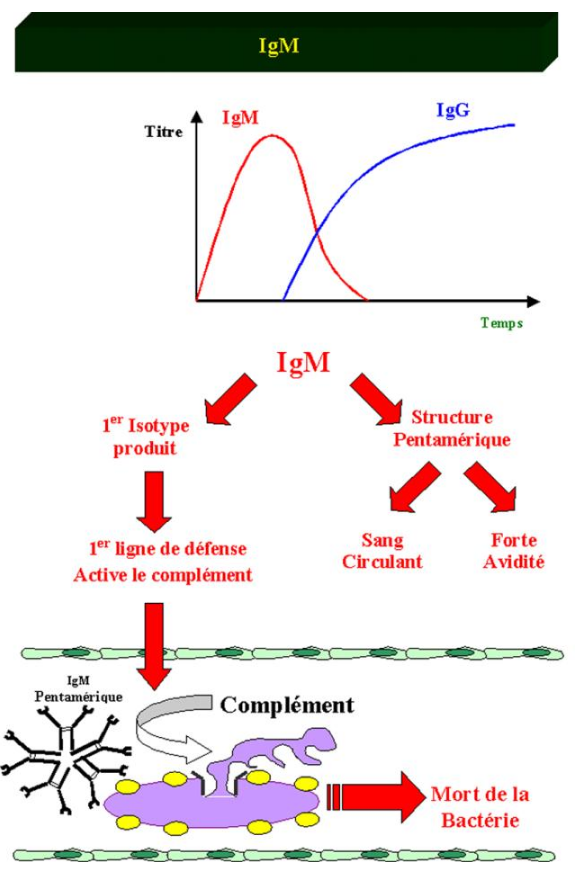
Les premiers anticorps produits lors de la réponse immunitaire à médiation humorale sont des IgM. Ces anticorps sont synthétisés avant l’apparition d’hypermutations somatiques. Ces IgM sont donc de faible affinité. Les IgM ont une structure pentamérique. Leurs dix sites de fixation à l’antigène peuvent se combiner simultanément à un antigène multimérique ce qui augmente l’avidité de ces anticorps pour l’antigène et compense ainsi leur relativement faible affinité. Une autre conséquence de la structure particulière des IgM est leur grande taille, confinant ce type d’immunoglobulines au sang circulant. Les IgM activent le complément de façon très efficace. La présence de microorganismes pathogènes dans le sang circulant peut avoir des conséquences sévères. La production rapide des IgM associée à leur capacité d’activer le système du complément fait de cette classe d’immunoglobulines un acteur clé dans le contrôle de ce type d’infection.
Figure 18 : Propriétés des IgM.
Les IgG sont toujours monomériques. De ce fait, l’affinité de ces anticorps pour l’antigène est critique pour leur efficacité. Au cours de la réponse immunitaire, dans les centres germinatifs, les cellules B vont donc augmenter l’affinité de leurs Ig de surface pour l’antigène.
Les IgG sont retrouvés dans le sang et les liquides extracellulaires. Les IgG sont de petite taille et diffusent aisément du sang vers les tissus.
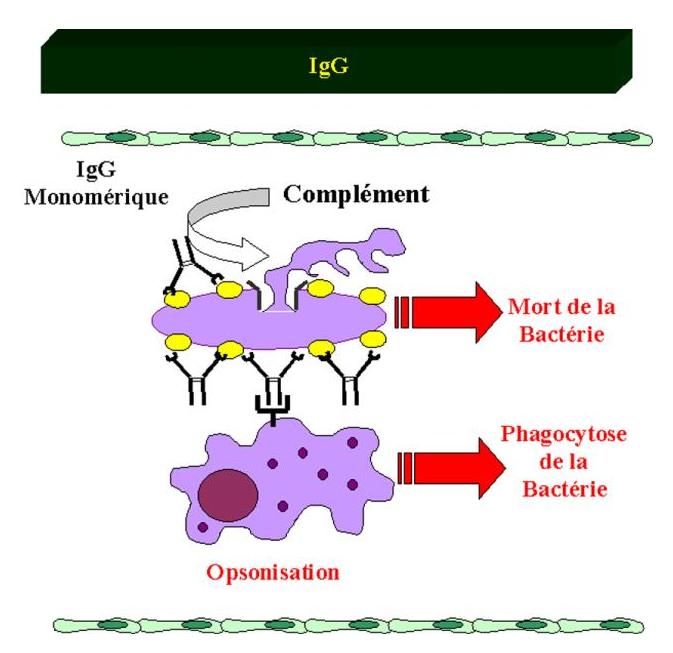
Les IgG opsonisent les microorganismes et activent le complément très efficacement.
Figure 19 : Propriétés des IgG.
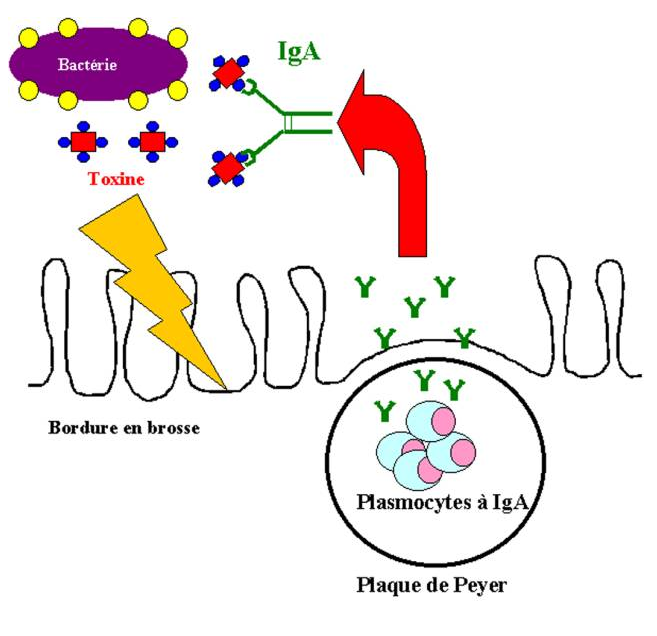
Les IgA sont présentes dans le sang et au niveaux des surfaces muqueuses.
Les IgA n’activent pas le complément. Ceci n’est pas étonnant car les IgA sont présentes au niveau des surfaces muqueuses où les protéines du complément et les cellules phagocytaires sont normalement absentes.
Les IgA agissent essentiellement comme des anticorps neutralisants.
Figure 20 : Propriétés des IgA.
Les IgE sont présentes à très faible concentration dans le sang. On les trouve à la surface des mastocytes situés sous la peau et les muqueuses et le long des vaisseaux du tissu conjonctif.
B – 1 – Transport des anticorps
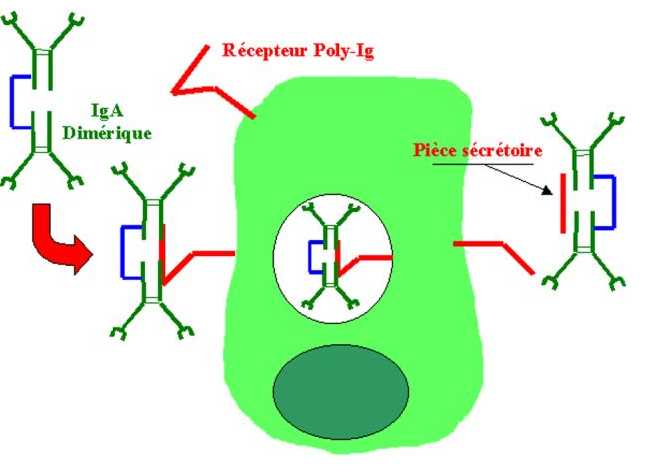
Les surfaces épithéliales muqueuses sont le site d’action et de synthèse des IgA. Les plasmocytes sécrétant les IgA sont localisés dans la lamina propria qui est la zone située immédiatement au-dessous de la membrane basale de nombreux épithéliums. Les IgA produites dans la lamina propria doivent être transportées à travers les épithéliums pour agir. Les IgA sont sécrétées sous forme dimérique où les deux molécules sont associées par une chaîne J. Cette forme polymérique d’IgA se fixe spécifiquement sur un récepteur appelé récepteur poly-Ig présent au pôle basolatéral des cellules épithéliales qui le synthétisent. Lorsque les IgA se fixent sur ce récepteur, le complexe est internalisé et transporté à travers le cytoplasme vers le pôle apical de la cellule. Ce processus est appelé transcytose. Au niveau apical, un clivage enzymatique du récepteur poly Ig permet la libération du dimère d’IgA. Une partie du récepteur poly Ig reste cependant accroché aux régions Fc des IgA. Ce fragment de récepteur est appelé pièce sécrétoire. Il protège les IgA contre la dégradation par les enzymes protéolytiques présentes sur les surfaces muqueuses et dans les sécrétions exocrines.
Figure 21 : Transcytose des IgA.
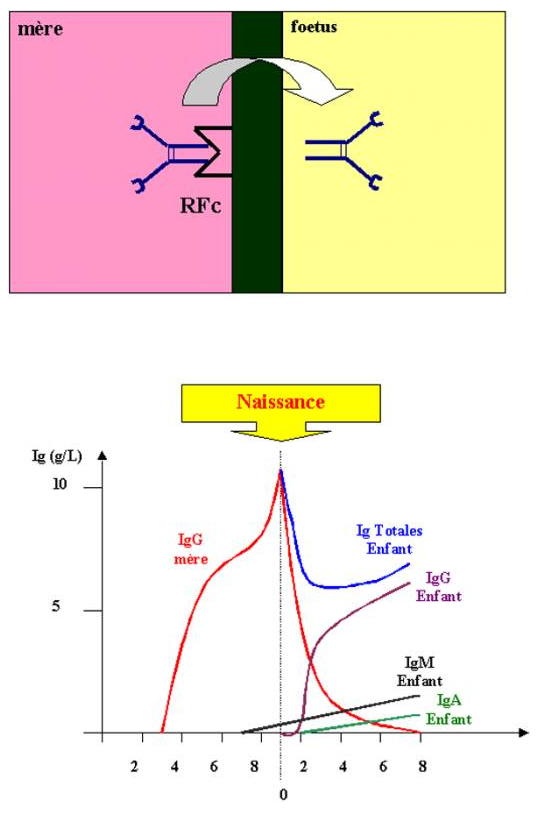
Les principaux sites de synthèse et de sécrétion des IgA sont l’intestin, le poumon, le lait maternel, les larmes et la salive. La fonction principale des IgA est de protéger les surfaces épithéliales contre des agents infectieux alors que les IgG protègent le milieu extracellulaire. Les IgA empêchent la fixation des bactéries et de leurs toxines aux cellules épithéliales, elles représentent donc la première ligne de défense contre de nombreux microorganismes. Les IgG maternels peuvent en effet traverser le placenta et être déversées dans la circulation sanguine du fœtus. Ainsi, à la naissance, les nouveau-nés ont un taux et un répertoire d’IgG plasmatiques équivalent à celui de leur mère. Le transport sélectif des IgG de la mère au fœtus est assuré par les récepteurs au fragments Fc présents au niveau du placenta. Deux récepteurs Fc fixent une molécule d’IgG et permettent son transport actif à travers le placenta. Les nouveau-nés sont particulièrement sensibles aux infections. Les IgA sécrétées dans le lait maternel et transférées dans l’intestin du nouveau-né le protège des infections bactériennes jusqu’à ce qu’il puisse produire ses propres IgA. Les IgA ne sont pas les seuls anticorps transmis par la mère à son enfant.
Figure 22 : Transport transplacentaire des Ig.
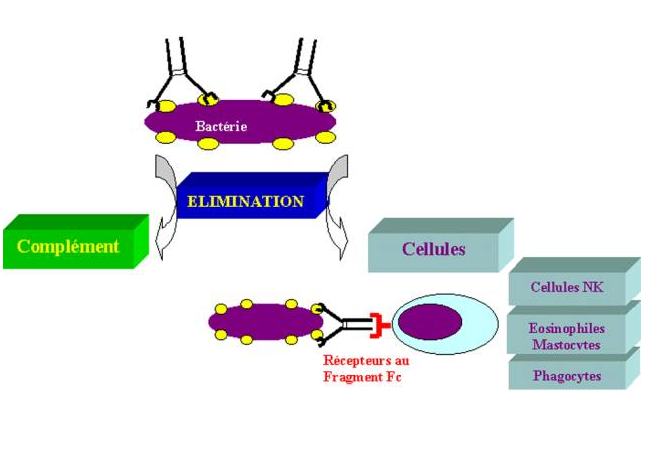
B – 2 – Interactions entre cellules et anticorps dans la réponse humorale
Les anticorps de forte affinité neutralisent les toxines, les bactéries et les virus mais ne peuvent par eux-même éliminer physiquement le pathogène ou ses produits de l’organisme. De plus, de nombreux microorganismes ne sont pas neutralisés par les anticorps et doivent donc être éliminés autrement. Afin d’éliminer ce type de pathogènes, les anticorps peuvent activer le système du complément qui favorise l’élimination des bactéries et des virus en augmentant leur phagocytose et leur endocytose. Toutefois, la fonction des anticorps n’est pas restreinte à la seule activation de protéines solubles. Ils peuvent activer une grande variété de cellules effectrices en interagissant avec les récepteurs de fragments Fc (RFc) qu’elles expriment à leur surface. Parmi ces cellules, les cellules phagocytaires (macrophages et neutrophiles) ingèrent les bactéries préalablement opsonisées par des anticorps. D’autres cellules comme les éosinophiles, les mastocytes et les cellules NK peuvent aussi être activées par les récepteurs de fragments Fc présents à leur surface.
B – 2 –1 – Complémentarité RFc/Isotype
Les RFc appartiennent à la superfamille des Ig. Les RFc constituent une famille de molécules qui peut fixer la portion Fc d’une molécule d’Ig. Chaque membre de la famille reconnaît spécifiquement une certaine classe d’Ig. De ce fait, l’isotype de l’anticorps fixé sur le pathogène détermine quelle cellule effectrice sera engagée pour l’éliminer. Les RFc sont des complexes multimoléculaires. La chaîne a est impliquée dans la reconnaissance spécifique de l’anticorps. les autres chaînes permettent le transport du récepteur vers la surface cellulaire ou la transduction du signal. La chaîne g a une structure très proche de la chaîne zeta du CD3. Les RFc possèdent dans leur région intracytoplasmique des ITAM qui peuvent fixer des protéines adaptatrices tyrosine kinases. Par ce biais, les RFc peuvent envoyer à la cellule des signaux activateurs. Parmi les récepteurs possédant un pouvoir activateur, on trouve certains RFcg, Rfca et le récepteur de forte affinité pour les IgE. Bien que la fonction principale des récepteurs Fc soit l’activation des cellules capables d’éliminer les agents pathogènes, certains RFc peuvent jouer un rôle dans la modulation de la réponse immune. Ainsi, le RFcgIIB fonctionne comme un récepteur inhibiteur. Son domaine ITIM intracytoplasmique fixe la protéine phosphatase SHP. Ce mécanisme permet de réguler négativement l’activation des cellules B naïves. Ce mécanisme a été évoqué pour expliquer la régulation de la réponse lymphocytaire B par les anticorps anti-idiotypes.
Les récepteurs Fc exprimés sur les cellules de Langerhans favorise la prise en charge d’immuns complexes et la présentation d’antigènes aux cellules T spécifiques. La fixation des immuns complexes sur les cellules folliculaires dendritiques permet la maturation de la réponse à médiation humorale.
Figure 23 : Complémentarité RFc/Isotype.
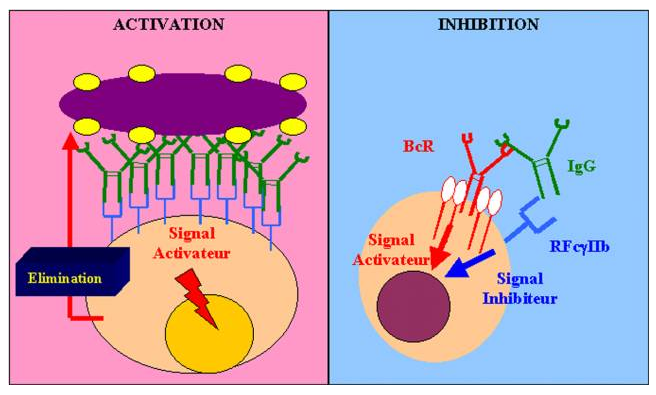
B – 2 – 2 – Activation des RFc par les complexes Ag-Ac
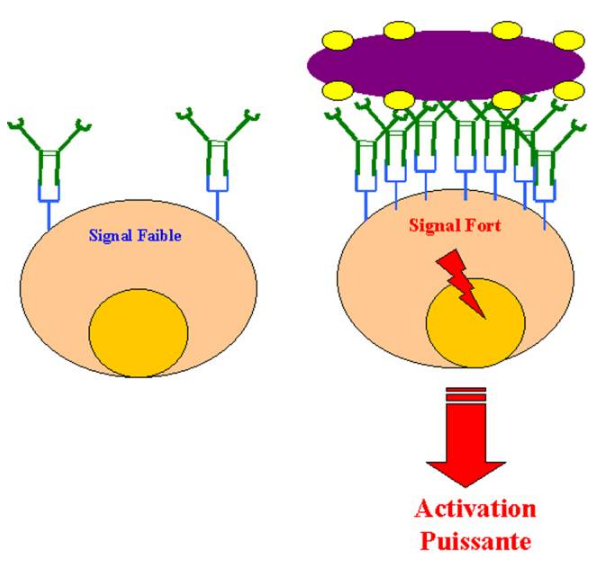
Les phagocytes sont activés par les anticorps d’isotype IgG et notamment par les IgG1 et les IgG3 qui interagissent avec leur récepteurs spécifiques présents à la surface des cellules phagocytaires. L’activation innapropriée des macrophages pouvant déclencher une réponse inflammatoire, il est essentiel que les RFc présents sur les phagocytes soient capables de distinguer un anticorps libre d’un anticorps fixé à un pathogène. Cette condition est remplie par l’agrégation des RFc lorsque de nombreux anticorps sont fixés sur un antigène multimérique à la surface d’un pathogène. De plus, si les RFc fixent les monomères d’Ig avec une faible affinité, il fixent les mêmes anticorps avec une affinité très forte lorsque ceux-ci sont agrégés à la surface d’un microorganisme. Finalement, les RFc permettent aux cellules effectrices de détecter des microorganismes recouvert d’anticorps spécifiques. Les anticorps fixés sur le pathogène interagissent avec des RFc spécifiques expliquant ainsi comment des cellules sans aucune spécificité pour un microorganisme peuvent l’identifier et l’éliminer du compartiment extracellulaire.
Figure 24 : Activation des RFc par les complexes Ag-Ac.
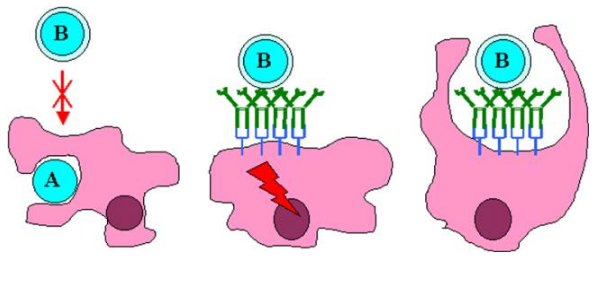
B – 2 – 3 – Phagocytose et dégradation des particules opsonisées
Les cellules non lymphoïdes les plus impliquées dans la réponse immunitaire à médiation humorale sont le macrophage et le polynucléaire neutrophile. De nombreuses bactéries sont reconnues, ingérées et détruites par les cellules phagocytaires. Cependant, certaines bactéries pathogènes ont des capsules polysacharidiques qui empêchent leur phagocytose directe. Ces bactéries deviennent sensibles à la phagocytose lorsqu’elles sont recouvertes d’anticorps spécifiques. Le recouvrement par des anticorps d’un microorganisme pour permettre sa destruction est appelé opsonisation. Les polysacharides bactériens appartiennent aux antigènes thymo-indépendants de type 2. L’opsonisation par les anticorps produits rapidement en réponse à ces antigènes, concourt à l’élimination de nombreuses bactéries encapsulées. L’internalisation et la destruction des microorganismes sont fortement augmentées par les interactions entre les anticorps opsonisants la bactérie et les récepteurs Fc. L’agrégation des récepteurs Fc par les anticorps augmente le pouvoir phagocytaire des cellules. La bactérie est endocytée puis séquestrée à l’intérieur de vésicules acides appelées phagosomes. La fusion du phagosome avec un lysozome génère un phagolysosome dans lequel le microorganisme est détruit par les enzymes protéolytiques.
Figure 25 : Phagocytose des particules opsonisées
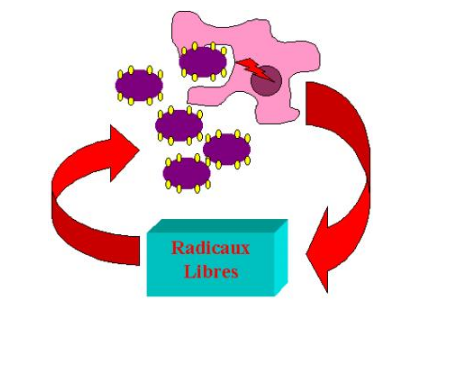
Les cellules phagocytaires peuvent aussi endommager les bactéries en générant une grande variété de produits toxiques. Les plus efficaces sont les radicaux activés de l’oxygène : peroxyde d’hydrogène, anion superoxyde et oxyde nitrique qui présentent une toxicité directe sur les bactéries. La production de ces métabolites est induite lors de l’agrégation des RFc par les anticorps. La large diffusion de ces radicaux les rend dangereux même pour la cellule qui les produit. Celle-ci peut par l’intermédiaire d’enzymes antioxydantes (catalase, superoxyde dismutase) se protéger de leurs effets.
Figure 26 : Dégradation des particules opsonisées par les radicaux libres.
B – 2 – 4 – Activation des cellules NK
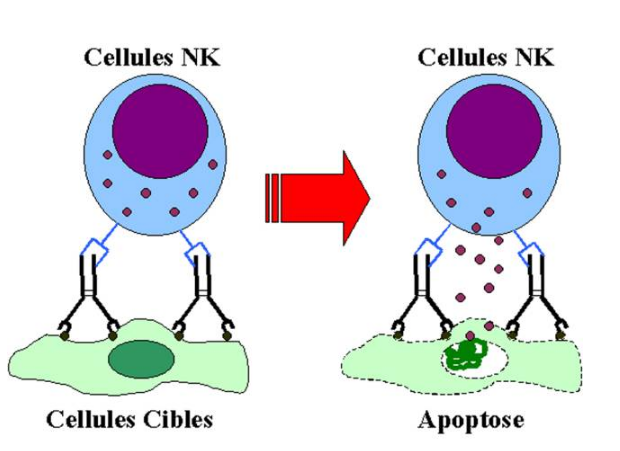
Les cellules infectées sont généralement détruites par les lymphocytes T qui reconnaissent des peptides étranger complexés aux molécules de classe I du CMH. Toutefois, une cellule infectée par un virus peut exprimer des protéines virales à sa surface. Celle-ci peuvent être reconnues par des anticorps spécifiques. Les cellules ainsi opsonisées peuvent être détruites par des cellules spécialisées appelées cellules NK.
Les cellules NK sont de grandes cellules lymphoïdes contenant des granules intracellulaires. Elles representent une petite fraction des cellules sanguines circulantes. Les cellules NK ne portent pas de récepteurs spécifique de l’antigène mais sont capables de reconnaître et de tuer des cellules infectées ou tumorales.
La destruction d’une cellule cible recouverte d’anticorps par les cellules NK est appelée ADCC (Antibody Dependant Cell-mediated Cytotoxicity). Ce phénomène est induit lorsque les anticorps fixés sur la cellule interagissent avec les RFc présents sur la cellule NK. Les cellules NK expriment le récepteur RFcgIII (CD16) qui reconnaît les IgG1 et les IgG3. Le mécanisme de lyse des cellules NK est identique à celui des cellules T CD8+ cytotoxiques et implique le système perforine-granzyme.
Figure 27 : Activation des cellules NK.
B – 2 – 5 – Rôle des RFce de forte affinité
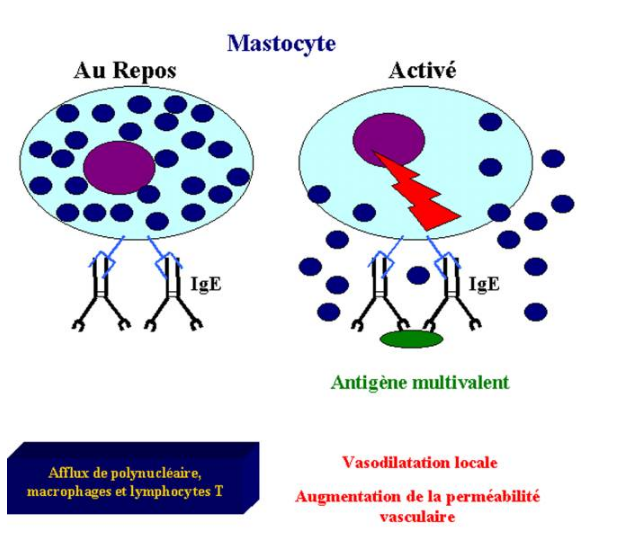
Lorsqu’un microorganisme traverse les barrières épithéliales et induit une infection localisée, l’hôte doit mobiliser ses moyens de défense et les diriger vers le site de l’infection. Les mastocytes jouent un rôle dans ce phénomène. Ce sont de grandes cellules riches en granules intracytoplasmiques. Ces granules contiennent de l’histamine et des médiateurs chimiques qui agissent rapidement sur la perméabilité des vaisseaux sanguins. Les mastocytes sont aisément détectés dans les tissus par la coloration au bleu de toluidine. On les retrouve dans le tissu conjonctif vascularisé juste sous les surfaces épithéliales (tractus digestif et respiratoire, derme).
Les mastocytes relarguent leurs granules et sécrètent des médiateurs lipidiques et des cytokines lorsqu’ils sont activés par les IgE et les IgG se fixant respectivement sur les RfceI et RFceIII. La plupart des RFc fixent les Ig complexées à un antigène. Au contraire, les RfceI fixent les IgE libres avec une très forte affinité. Les RfceI sont retrouvées sur les polynucléaires basophiles. Les polynucléaires éosinophiles peuvent eux aussi exprimer RfceI mais seulement après leur activation et leur recrutement au niveau des sites inflammatoires. Bien que les mastocytes soient généralement associés de façon stable aux IgE, ils ne sont pas activés par la simple fixation de ces anticorps au RfceI. L’activation du mastocyte a lieu lorsque les IgE de surface sont agrégés par un antigène multivalent. Ce signal conduit à la libération des granules cytoplasmiques et à la synthèse et au relarguage de médiateurs lipidiques (prostaglandines, leucotriènes) et la libération de cytokines. L’ensemble de ces médiateurs induit une réaction inflammatoire locale. La conséquence immédiate de l’agrégation des IgE est la dégranulation des mastocytes qui a lieu en quelque seconde. Ce phénomène permet la libération d’histamine conduisant à une vasodilatation et à une augmentation locale de la perméabilité des vaisseaux induisant une accumulation rapide de liquide dans les tissus adjacents. Très rapidement, on observe un afflux de polynucléaire neutrophiles, éosinophiles, de macrophages puis de lymphocytes T Cet afflux cellulaire est très rapide puisqu’observé dans les minutes ou les heures suivants l’activation des mastocytes. Ainsi, les mastocytes font parties des premières lignes de défense vis à vis des pathogènes pénétrant dans l’organisme par les barrières épithéliales.
Figure 28 : Rôle des Rfce dans l’activation des mastocytes.
B – 2 – 6 – Rôle des IgE dans la défense anti-parasitaire.
Les mastocytes ont trois fonctions principales. Premièrement, leur localisation sous-muqueuse fait de ces cellules des sentinelles particulièrement efficaces pour recruter des cellules de l’immunité spécifique et non spécifique en cas d’infection. Deuxièmement, ces cellules peuvent augmenter le drainage des sites de l’infection vers les ganglions afférents permettant ainsi l’activation rapide des lymphocytes naïfs. Troisièmement, leur faculté d’induire la contraction des fibres musculaires peut contribuer à l’élimination physique des micro-organismes présents dans le poumon et le tube digestif. La liaison de l’antigène avec les IgE à la surface des mastocytes induit leur activation rapide et le recrutement des polynucléaires éosinophiles et basophiles. De plus en plus d’arguments existent en faveur du rôle de ce type de réponse dans la défense de l’organisme contre l’agression par des parasites.
L’implication des mastocytes dans l’immunité anti-parasitaire est suggérée par la mastocytose qui accompagne l’infection intestinale à helminthes. De plus, les souris mutantes déficientes en mastocytes sont particulièrement sensibles aux infections par les nématodes intestinaux comme les trichines.
D’autres mécanismes peuvent être mis en oeuvre au cours de la réponse anti-parasitaire . Ainsi, de nombreuses observations ont montré l’implication des IgE spécifiques et des éosinophiles. En effet, l’infection par certains parasites, notamment des helminthes est associée à une hyperéosinophilie et à la production d’IgE. Les éosinophiles semblent être responsables de la destruction directe des parasites. On observe en effet fréquemment sur des coupes de tissu infecté des éosinophiles fixés sur le parasite. Des expériences in vivo ont montré que l’élimination des éosinophiles par des anticorps monoclonaux augmentait la sévérité de l’infection à Shistosoma mansoni. In vitro, les éosinophiles peuvent tuer ce parasite en présence d’IgE spécifiques.
